Обобщающий урок
по теме
«Периодический закон и периодическая
система химических элементов
Д.И.Менделеева. Строение атома».
Цели
урока: Обобщить знания обучающихся по
данной теме, проверить степень усвоения материала; развивать интерес к предмету
и познавательную активность ребят; учить работать с дополнительной литературой,
применять свои знания на практике.
Оборудование:
Настенная таблица «Периодическая
система химических элементов Д.И.Менделеева». Карточки-задания. Штативы, пробирки,
спиртовки, прибор для получения газов, химический стакан, колба, предметное
стекло, держатель; растворы NаOH, HCl, H2SO4 , известковая вода, спиртовой раствор йода, мел,
оксид меди (II), вода.
Ход урока.
1.
Начальная
организация учащихся на работу.
Класс делится на 4 группы
Каждая группа садится за свой стол
Во главе группы - консультант
2.
Повторение
материала
Сегодня мы совершим экскурсию в страну химических
элементов. Жители этой страны очень отличаются по характеру, но живут соблюдая законы своей страны. Прежде, чем разрешить
нам въезд в свою страну жители предлагают ответить на
ряд вопросов.
Задание
№1 «Пин - понг»
1.
Кем и когда был
открыт периодический закон?
2.
Где родился
Д.И.Менделеев? Кто были его родители?
3.
Откуда произошла
фамилия Менделеев?
4.
Где учился
Д.И.Менделеев? Кем он хотел стать? Почему ему это не удалось?
5.
Какое высшее
учебное заведение окончил Д.И.Менделеев?
6.
Кем и где работал
Д.И.Менделеев во время своего великого открытия?
7.
В каком году и по какой причине
Д.И.Менделеев скончался?
8.
Как читается
периодический закон по Д.И.Менделееву?
9.
Современная
формулировка периодического закона?
10.
Какие
подтверждения периодического закона, известные еще при жизни Менделеева, вы
знаете?
11.
Верно ли я даю
определение?
Порядковый
номер элемента равен числу электронных слоев в атоме.
По номеру
периода можно определить валентность.
12.В чем причина
плавного и скачкообразного изменения свойств химических элементов в
периодах?
13.В чем вы видите значение периодического закона для
науки, техники?
Въезд в страну разрешен. Произошло первое
знакомство с жителями. Какую характеристику вы можете им дать?
Задание « Расскажи обо мне»
1.Дать характеристику элементу №20.
2.Дать характеристику элементу №16.
3.Дать характеристику элементу №17.
4.Дать характеристику элементу №11.
Один человек
от каждой команды выполняет задание у доски.
К нам
обратились жители с просьбой о помощи. Некоторые из них потерялись, необходимо
найти их вторую половину.
Задание 2 «Расскажи обо мне».
Дать
характеристику элементу №17
План
характеристики
1. Положение элемента в ПС:
а) порядковый
номер;
б) Аr;
в) номер
группы;
г) номер
периода.
2. Строение атома.
а) заряд ядра;
б) число
протонов;
в) число
нейтронов;
г) число
электронов.
3. Валентность.
4. Электронная формула элемента.
5. Высший оксид, его характер.
6. Написать уравнение подтверждающее характер оксида.
Задание «Кто быстрее».
Nа … , Al2 … , Nа2… , …SO4 , …(SO3)3 , Cа3… , Nа3 … , …(PO4)2
Подводим итоги.
Следующее
задание состоит в том, чтобы вы рассказали об их соседях.
Задание « Мои соседи».
А от каждой команды по одному по одному человеку – «
Установи соответствие».
Вы знаете, что в подъездах устанавливаются кодовые
замки.
Группа жителей забыла код. Необходимо оказать им
помощь.
Предлагаю задание «Составь код».
А в это время по одному человеку от каждой команды. Им
предлагается задание «Что в имени тебе
моем».
Молодцы! Вы
хорошо справляетесь с заданиями. Но настоящие путешественники должны иметь все
и даже делать волшебные превращения. Вы уже догадались, что пришло время Д/З. Каждая команда
по очереди демонстрирует свое задание.
1.
Получить хлорид
натрия с помощью реакции нейтрализации, выделить его кристаллы из раствора
путем выпаривания.
2.
Получить кислород
и доказать его наличие.
3.
Получить водород
и собрать его методом вытеснения воздуха.
4.
Получить сульфат
меди (II), выделить его кристаллы из раствора путем выпаривания.
Инструкция экипажу №1.
Получить
хлорид натрия с помощью реакции нейтрализации, выделить его кристаллы из
раствора путем выпаривания.
1.
Налить в пробирку
раствор гидроксида натрия. Капнуть фенолфталеин, добавить раствор соляной
кислоты до исчезновения окраски.
2.
Поместить на
предметное стекло каплю полученного раствора, закрепить стекло держателем.
3.
С помощью
спиртовки выпарить раствор на предметном стекле до образования кристаллов
хлорида натрия.
4.
Объяснить
наблюдаемые явления, записать уравнения реакций, указать тип химической связи в
молекуле хлорида натрия.
Инструкция экипажу №2.
Получить
кислород и доказать его наличие.
1.
Собрать прибор
для получения и собирания кислорода.
2.
В пробирку
насыпать на ¼ ее
объема перманганата калия. Закрыть пробирку пробкой с газоотводной трубкой.
3.
Конец
газоотводной трубки опустить до дна стакана.
4.
Зажгите спиртовку
и начните нагревать пробирку.
5.
Полноту
наполнения стакана кислородом проверьте лучинкой.
Инструкция экипажу№3.
Получить
водород и собрать его методом вытеснения воздуха.
1.
В подготовленный
прибор поместить 2 – 3 гранулы цинка, плотно закрыть пробку с воронкой и налить
соляной кислоты, чтобы она покрыла гранулы.
2.
Собрать водород
методом вытеснения воздуха.
3.
Установить
наличие водорода при помощи лучинки.
Инструкция экипажу№4.
Получить сульфат меди (II), выделить его кристаллы из раствора путем выпаривания.
1.
Насыпать в пробирку оксид меди (II),
прилить раствор серной кислоты, нагреть
над спиртовкой до появления признаков реакции.
2.
Поместить на предметное стекло каплю полученного раствора, закрепить стекло держателем.
3.
Выпарить над спиртовкой каплю раствора до образования кристаллов сульфата меди
(II).
4.
Объяснить наблюдаемые явления, написать уравнения реакций, указать тип химической связи в молекуле сульфата меди (II).
Задание
№3. Установите соответствие
А. атомы состав
атома
хим. элемента
_
фосфор 16р, 20n, 16e
_
8p,
8n, 8e
_
магний 15р, 16n, 15e
_
12p, 12n, 12e
_
кислород 15р, 16n, 16е
_
6p,
6n, 6e
_
12е, 10n, 10е
Б. атомы состав атома
хим. элемента
фтор 10p, 10n, 9e
_
6p, 6n, 6e
_
калий 12p, 12n, 10e
_
9p, 10n, 9e
_
углерод 19p, 20n, 19e
Задание
№5 «Мои соседи»
А.
1. Расположите в порядке усиления металлических свойств следующие химические
элементы:
а) калий
б) натрий
в) рубидий
г) литий
д) цезий
Б.
1. Расположите в порядке уменьшения неметаллических свойств следующие химические элементы:
а) кислород
б) азот
в) фтор
г) углерод
д) бор
Задание №6 «Составь код»
1. В чем физический смысл номера периода?
а) показывает количество электронов на внешнем
электронном уровне;
б) показывает количество электронных уровней;
в) соответствует валентности элемента.
2. В
побочные подгруппы периодической системы входят:
а) химические элементы малых периодов;
б) химические элементы больших
периодов;
в) химические элементы малых и
больших периодов.
3.
Какое из следующих свойств атомов химических элементов возрастает в
группах по мере возрастания заряда ядра?
а) число электронов на наружном слое;
б) атомный радиус;
в) электроотрицательность.
4.
Какое из следующих свойств атомов химических элементов не изменяется в
периоде?
а) число электронных слоев в атоме;
б) число электронов в наружном
электронном слое;
в) атомные радиусы.
5. Побочные подгруппы составляют:
а) только металлы; в) металлы и неметаллы.
б) только неметаллы;
6. Какое из следующих веществ имеет в твердом
состоянии атомную кристаллическую решетку?
а) кислород; в) йод;
б) вода; г) алмаз.
Задание №7. «Что в имени тебе
моем».
Определите, в главных подгруппах
каких групп периодической таблицы находятся химические элементы, электронные
схемы атомы которых приведены в левом столбце таблицы. Буквы соответствующие
правильным ответом, образуют название элементарной
частицы.
|
Электронные
схемы строения атомов |
Г р
у п п ы |
|||||
|
I |
III |
IV |
V |
VI |
VII |
|
|
)_ )_ 2e 5e |
Э |
Н |
П |
П |
Ч |
С |
|
)_
)_ )_ 2e
8e 3e |
Е |
Р |
Л |
И |
Р |
Д |
|
)_
)_ )_ 2e
8e 7e |
О |
М |
Ь |
Ю |
Г |
О |
|
)_ )_ 2e 1e |
Т |
У |
Ф |
Ц |
А |
В |
|
)_
)_ )_ 2e
8e 4e |
К |
Т |
О |
Р |
О |
Е |
|
)_ )_
)_ 2e
8e 6e |
Й |
Н |
П |
И |
Н |
Ь |
На досуге жители страны химических элементов
любят разгадывать кроссворды. Я вам предлагаю один из них.
Задание № 9. Химический
кроссворд.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
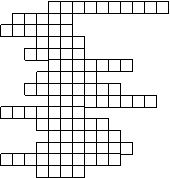
1. Химический элемент с
порядковым номером 17.
2. Сложное вещество, в состав
которого входят атомы водорода и
кислотный остаток.
3. Химический элемент,
названный в честь великого русского ученого.
4. Химический элемент,
электронная структура которого -) ) ) ).
5.
Растворимое в воде основание. 2 8
8 1
6. Химический элемент, атомы
которого имеют электронную формулу
1s2 2s2 2p6 3s2 3p4 .
7. Свойство атомов, которое
Д.И.Менделеев принял за основное при систематизации химических элементов.
8. Химический
элемент, электронная формула которого - ) ) ) .
9.
Химический элемент с порядковым номером №3.
2 8 4
10. Элементарные частицы, по
числу которых могут отличаться атомы одного и того же химического элемента.
11. Отрицательно заряженные
частицы.
12. Простые вещества,
обладающие хорошими теплопроводностью, электропроводностью,
металлическим блеском.
13. H2
14. 1s2 2s2 2p6 3s2 .
15. Химический элемент,
название которого произошло от названия планеты.
16. H2 Si O3 – это … кислота.
17. Частица вещества.
Выигрывает тот, кто первый назовет ключевое
слово (2).
Теперь подведем итоги.
Пришло время возвращаться. Вы порадовали
жителей страны своими знаниями.
Выставление оценок с комментариями учителя
и учеников.
Тема: Аминокислоты.
Цель: 1).
Изучить строение и свойства аминокислот.
2). Указать их исключительное
значение, т.к из них построены молекулы белков,
играющих важную роль в жизненных процессах.
3). Продолжить формировать
понятие «рациональное питание».
Оборудование: штатив с пробирками, спиртовка, спички,
химический стакан с водой, медная проволока, держатель, формальдегид, спирт
этиловый, аммиачный раствор оксида серебра.
На столах учащихся:
аминоуксусная кислота, химический стакан с водой, пробирки, метилоранжевый.
Ход
урока.
I.
Начальная
организация (1мин).
II.
Проверка знаний
учащихся (10мин).
А
Тестовый контроль по теме «Кислородсодержащие органические вещества» по
вариантам.
Б. Решить задачу на определение формулы вещества.
В.
Два ученика выполняют экспериментальные задания.
III.
Переход к изучению новой темы (1мин).
Из курса общей биологии вы уже слышали об этих
веществах. Знаете, что из аминокислот строятся белки. А это основа жизни. На
сегодняшнем уроке нам нужно выяснить строение и свойства этих веществ. На
основе этих знаний отметим их уникальную особенность.
Б. Задача
При полном сгорании 3,9г. углеводорода получили 13,2г.
углекислого газа и 2,7г. воды.
Плотность паров вещества равна 3,482г/л.
Выведите молекулярную формулу углеводорода.
В 1. Лабораторный опыт
Окисление спирта в альдегид.
Задание. Осуществить превращение этилового спирта в
ацетальдегид.
Составьте уравнение реакции.
В 2. Лабораторный опыт
Взаимодействие
глицерина с гидроксидом меди(II).
Задание.
Проведите реакцию глицерина с гидроксидом меди (II).
Что вы наблюдаете?
Девиз урока: Наиболее рациональный прием изучения нового
есть перенос
знаний ранее изученного (известного) на
новый изучаемый объект (на неизвестное).
IV.
Изучение новой
темы (24 – 25мин)
- COOH
Даю определение
- NH2
Посмотрите на таблицу «Аминокислоты».
Какое
вы можете дать определение аминокислотам?
2.
Физические
свойства:
а)
бесцветные кристаллы
б) хорошо растворимые в воде
в)
имеют сладкий вкус
3.
Получение
а) гидролиз белков
б) микробиологический
в) заменяют атом водорода в
углеводородном радикале карбоновой кислоты, а затем атом галогена меняем на
группу –NH2
CH3 – COOH + Cl2 CH2 - COOH + HCl
![]() |
|
Cl
![]() CH2 - COOH + NH3 CH2
– COOH + HCl
CH2 - COOH + NH3 CH2
– COOH + HCl
| |
Cl NH2
4.
Изомерия. Номенклатура. 4 3 2 1
а)
Строение углеродной цепи CH3 - CH2 - CH - COOH
|
2 - аминобутановая кислота NH2
CH3
| 2 амино – 2 метил –
пропановая кислота CH3 -- C-- COOH
|
NH2
б) Положение – NH2
в)
Что именно определяет химические
свойства?
(функциональная группа – это
группа атомов обуславливающая химические свойства.)
- COOH- свойства характерны для кислот
- NH2 - свойства оснований
г)
Как называются вещества, обладающие двойственными свойствами?
(
амфотерные ).
Учитель.
Кислотные или основные свойства мы устанавливаем при помо -
щи индикатора.
Испытайте раствор аминоуксусной кислоты
фенолфталеином?
Что наблюдаете?
Какой вывод можете сделать?
Фенолфталеин окраску не меняет в растворе нет
ионов H и ионов OH
Учитель:
Аминокислоты в растворах существуют в виде цвиттер – ионов
(биполярных).
CH2 - COOH CH - COO Происходит внутренняя нейтрализация.
| |
NH2 H- N: H
|
H
NH2 – CH2 – COOH + NaOH
NH2 - COONa + H2O
H2 N – CH2 - COOH + NaOH [NH3 - CH2 COOH] Cl
NH2 - CH2 - COOH + HO
C2 H5 NH2 - CH2 – COO – C2 H5 + H2O
0
H 0
// | //
NH2 – CH2 – C + H – N – CH2 - C
\ \
OH OH
0 H
|| |
NH2 - CH2 - C – N – CH2 - COOH + H2O дипептид
\ \
OH OH
0 H
|| |
- C – N – пептадная связь
Группа
– NH2 может располагаться у любого углеродного
атома по отношению к карбоксильной группе. Применяют и тривиальную
номенклатуру.
(
… и т.д.),
и заместительную.
Тривиальная
- C – C – C – C – COOH
5 4 3 2
1
Заместительная
Номенклатура
CH3 – CH - COOH 2-
аминопропановая кислота (
- аминопро-
| пионовая кислота).
NH2
CH3 -
CH – CH2 - COOH 3-
аминобутановая кислота ( - аминомас-
| ляная кислота).
NH2
CH3 – CH – CH2 – CH2 – COOH 4- аминопентановая кислота (
- аминова-
| лериановая кислота).
NH2
Полипептиды имеют очень
большое значение для биологических процессов живых организмов.
Ученым, например, доказано, что пентидные
системы играют важную роль в работе мозга. В мозгу уже открыты так называемые
пептиды сна, памяти, страха. Эти исследования дадут новые возможности
направленного и разумного воздействия на
мозг, в том числе и для лечения многих психических заболеваний.
6.
Значение
аминокислот
Сообщение ученика (3мин)
I.
Закрепление
нового материала
1. Строение и свойства
каких веществ изучали на уроке?
2. Какие вещества называются
аминокислотами?
3. Какими свойствами и почему обладают
аминокислоты?
4. Почему присутствие аминокислот в
организме обязательно?
5. Почему возможно соединение аминокислот
друг с другом?
6. Решить задачу.
Определить молекулярную формулу
аминокислоты, массовые доли
углерода,
водорода, кислорода и азота в которой составляют 32; 6,66;
42,67% и 18,67% соответственно.
Напишите структурную формулу этой
аминокислоты и назовите ее.
V.
Д/З. 43
№11.
Тестовая работа по органической химии
1.
С какими из
перечисленных веществ будет взаимодействовать уксусная кислота
а) C2 H6 и HCl в) C3 H8 и NH3
б) C2 H5 OH и Cl2 г) NаOH и C2 H5Cl
2.
При кипячении уксусного альдегида с гидроксидом меди (II) выпадает осадок.
а) голубой б) красный в) васильковый
3.
При взаимодействии спирта и карбоновой
кислоты образуется:
а) соль б) простой эфир в) сложный эфир
4.
Жиры образуются при взаимодействии
а)
соли и неорганической кислоты
б)
кислоты и основания
в)
глицерина и карбоновой кислоты.
5. Этилацетат можно получить при взаимодействии:
а) C2 H5 OH и H2 SO4 в) C2 H5 OH и CH3 – COOH
б) CH3 – COOH и CH3 OH
г) C2 H5 OH и C2 H5 OH
6. Реакция Кучерова – это реакция получения
а)
метана
в) уксусного альдегида
б) ацетилена г) анилина
7. Водный
раствор аминов в присутствии фенолфталеина имеет окраску
а) малиновую в) синюю
б) желтую г) красную
8. Вещества X и Y в схеме
превращений
180 +HCl
С2 H5 OH -------- X-------- Y
H2 SO4
а)
X- этилен ,
Y- хлорэтан
б)
X- этилен, Y -дихлорэтан
в) X- диэтиловый эфир, Y- хлоруксусная кислота
г) X- уксусный альдегид Y- этанол
Тестовая
работа по органической химии
1. Распознать глицерин, ацетальдегид можно с
помощью:
а)
Cи(OH)2 б) Аg2 O
в) Nа OH
2. Самую высокую степень диссоциации имеет
вещество, формула которого:
а) CH3
- COOH б) CH2 - COOH в) CH2
- COOH
| |
Cl F
3. Формулы веществ X и Y в схеме
превращений
+X O +Y O
C2 H2
---- CH3
CHO ---- A ---- CH3 – C
O – CH3
а) X – X2 O; Y – CH3 OH в) X – H2 O; Y – C2
H5 OH
б) X - XCHO; Y – CH3
OH г) X – HCHO; Y –
C2 H5 OH
4. Этанол реагирует с обоими
веществами:
а) метанолом и этиленом
б) кислородом и уксусной
кислотой
в) гидроксидом меди (II) и кислородом
г) формальдегидом и кислородом
5. Сложный эфир можно получить
при взаимодействии:
а) С2
Н5 OH с C2 H5 OH в) CH2 = CH2 с HCl
б) CH3
COOH с Na2 CO3 г) CH3 COOH с C2 H5 OH
6. Этилат натрия получается при
взаимодействии:
а) CH3 OH с Na в) C2 H5 OH c Na
б) CH3 OH с Na2 CO3 г) C2
H5 OH с Na2
CO3
7. Реакция Н. Н. Зинина – это получение
а) анилина в) ацетилена
б) бензола г) этанола
8. Амины – это вещества, которые
проявляют свойства:
а) кислотные в) кислотные и основные
б) основные г) нейтральные